新型コロナワクチンの特例臨時接種(全額公費)は令和6年3月31日で終了しました。
令和6年4月以降は、以下により原則自己負担による接種が行われます。
- 令和6年度秋冬に自治体による定期接種(一部助成があります。助成や実際の接種については、お住いの市町村にご確認ください。)
[対象]
・65歳以上
・60~64歳で対象となる方(心臓、腎臓または呼吸器の機能に障害があり、身の回りの生活が極度に制限される方、ヒト免疫不全ウイルス(HIV)による免疫の機能に障害があり、日常生活がほとんど不可能な方) - 「1.」以外場合
ご希望の方は、任意接種として、自費で接種していただくことになります。
秋田県新型コロナワクチン相談センター(0570-066-567)は令和6年3月31日で終了しました。
接種後の症状が長引く・つらい場合は、かかりつけ医等身近な医療機関に相談してください。
(令和6年3月31日)
- 新型コロナワクチンの全額公費による接種は終了しました。
新型コロナワクチンに関する情報
市町村の情報
| 県 北 | 県 央 | 県 南 | |||
|---|---|---|---|---|---|
| 大館市 | 鹿角市 | 秋田市 | 男鹿市 | 由利本荘市 | にかほ市 |
| 小坂町 | 北秋田市 | 潟上市 | 五城目町 | 大仙市 | 仙北市 |
| 上小阿仁村 | 能代市 | 八郎潟町 | 井川町 | 美郷町 | 横手市 |
| 藤里町 | 三種町 | 大潟村 | 湯沢市 | 羽後町 | |
| 八峰町 | 東成瀬村 | ||||
市町村名をクリック/タップすると外部サイトへ移動します。
相談窓口
各種相談
●新型コロナワクチンに関するお問い合わせ
| 設置者 | 厚生労働省 |
| 窓口名称 | 厚生労働省新型コロナワクチンコールセンター(令和6年9月末で終了しました) |
| 電話番号 | 0120-700-624 |
| 受付時間 | 9時から21時まで(毎日) |
●具体的な接種などの相談
お住まいの市町村へお問い合わせください。
差別やいじめに関する相談
- 職場におけるいじめ・嫌がらせなどに関する相談窓口はこちら
- 人権相談に関する窓口はこちら
- (子ども)学校等におけるいじめ・嫌がらせなどに関する相談窓口は「子どものSOS相談窓口」
- (子ども)いじめ・嫌がらせなどについての人権相談に関する窓口はこちら(電話やメールで相談を受け付けています)
ワクチン接種実績
- これまでのワクチン総接種回数(令和6年3月30日まで)New
| 接種回数 | |
| 全国 | 436,193,341 |
| 秋田県 | 3,956,327 |
| 内1回目 | 内2回目 | 内3回目 | 内4回目 | |||||
|---|---|---|---|---|---|---|---|---|
| 接種回数 | 接種率 | 接種回数 | 接種率 | 接種回数 | 接種率 | 接種回数 | 接種率 | |
| 全国 | 104,753,261 | 80.45% | 103,464,961 | 79.48% | 86,697,731 | 67.06% | 59,491,484 | 46.16% |
| 秋田県 | 865,317 | 87.58% | 856,098 | 86.73% | 769,044 | 78.73% | 607,034 | 62.60% |
| 内5回目 | 内6回目 | 内7回目 | ||||
|---|---|---|---|---|---|---|
| 接種回数 | 接種率 | 接種回数 | 接種率 | 接種回数 | 接種率 | |
| 全国 | 38,780,598 | 30.39% | 25,470,793 | 20.31% | 17,534,513 | 13.98% |
| 秋田県 | 408,741 | 42.79% | 272,502 | 28.97% | 177,591 | 18.88% |
*接種率の計算に用いる人口データは令和5年1月1日現在の住民基本台帳に基づくデータになります。接種率の算定にあたっては、死亡した方の、接種日が令和4年末までの接種回数は除いています。
ワクチンの有効性と安全性
新型コロナワクチンは発症を予防し、重症者や死亡者の発生をできる限り減らすことを目的に接種が進められています。
一方で、ワクチン接種後は免疫反応により、副反応が生じることがあります。
新型コロナワクチン接種後の主な副反応としては、接種部位の痛み、疲労、頭痛、筋肉や関節の痛み、悪寒、下痢、発熱等がみられることがあります。このような症状の大部分は、接種後数日以内に回復していますが、症状が重かったり、長引く場合は、接種した医療機関やかかりつけ医にご相談ください。かかりつけ医等において、さらなる対応が必要と判断した場合、専門的な医療機関に紹介するよう体制を整備しています。
なお、副反応による健康被害(病気になったり障害が残ったりすること)が生じた場合には、救済制度が設けられています。
新型コロナワクチン接種後の健康調査(国内調査)
新型コロナワクチン接種を受けた方々を対象に、抗体価の推移や副反応の発生頻度などが調査され、公表されています。
- オミクロン株対応1価ワクチンの追加接種についてはこちら(厚生労働省外部リンク)
- オミクロン株対応2価ワクチンの追加接種についてはこちら(厚生労働省 外部リンク)
- 4回目接種についてはこちら(厚生労働省 外部リンク)
- 3回目接種についてはこちら(厚生労働省 外部リンク)
- 1・2回目接種についてはこちら(厚生労働省 外部リンク)
副反応疑い報告
ワクチン接種後に生じうる副反応については、医療機関からの報告が収集され、厚生労働省の審議会にて専門家による評価が行われ、結果が公表されています。
新型コロナワクチンの副反応疑い報告(厚生労働省 外部リンク)
ワクチン接種後の副反応等に対応する医療体制について
新型コロナワクチンの接種を受けた後、免疫反応等により、副反応が生じることがあります。
多くは、数日以内に回復していますが、症状が重かったり、長引く場合にはかかりつけ医等の身近な医療機関に相談・受診してください。
また、受診先の医療機関で診察の上、さらなる対応が必要とされた場合は、地域の基幹病院(救急告示病院等)や専門的な医療機関を紹介します。
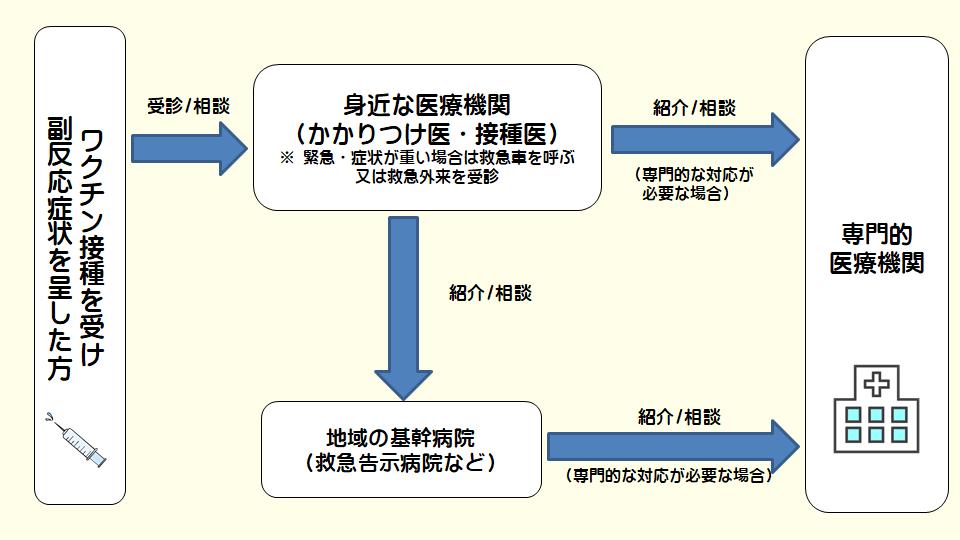
- やかかりつけ医がいない場合は、お近くの医療機関を受診してください。
秋田県内の医療機関の検索は「医療情報ネット」(外部リンク)をご利用ください。
予防接種健康被害救済制度について
一般的に、ワクチン接種では、副反応による健康被害(病気になったり障害が残ったりすること)が起こることがあります。極めて稀ではあるものの、なくすことができないことから、救済制度が設けられています。
救済制度では、予防接種によって健康被害が生じ、医療機関での治療が必要になったり、障害が残ったりした場合に、予防接種法に基づく救済(医療費・障害年金等の給付)が受けられます。
新型コロナワクチンの接種についても、健康被害が生じた場合には、予防接種法に基づく救済を受けることができます。
.jpg)